免疫抑制肿瘤微环境(TME)是胶质母细胞瘤(GBM)的一个显著特征,胶质母细胞瘤是目前对免疫疗法抵抗严重的原发性脑癌,GBM-TME背后的机制仍有待探索。中山大学第一附属医院张弩、刘雪松、张茂雷团队在Cell Reports Medicine(IF 11.7)上发表研究论文“Lnc-H19-derived protein shapes the immunosuppressive microenvironment of glioblastoma”,研究结果强调了H19-IRP在通过招募MDSCs和TAMs产生免疫抑制性GBM-TME中的功能,支持了用肿瘤疫苗靶向H19-IRP治疗GBM的想法。
维真助力:Lv-gRNA和Lv-shRNA载体

sgH19和shH19作用结果图
01 研究结果
1、H19-IRP缺乏破坏GBM进展中免疫抑制性TME的形成
首先作者在临床GBM样本数据库中寻找与免疫相关的lncRNA,发现H19在GBM组织中高度上调,是GBM中潜在的免疫抑制lncRNA。进一步探究H19对GBM TME的影响机制,发现H19编码一种以前未被发现的蛋白质H19-IRP,与GBM患者的低生存率有关。鉴于H19-IRP主要在肿瘤细胞中表达,作者研究了H19编码蛋白是否影响肿瘤细胞活性。sgRNAs介导的H19-Irp敲除不影响H19的表达,但显著抑制了H19-Irp的表达。敲除和过表达H19-Irp都不会影响细胞在体外的增殖、迁移或凋亡,表明H19-Irp与这些肿瘤特征无关。生物信息学分析显示H19与免疫抑制性TME相关,作者假设H19通过其编码产物影响GBM-TME,通过构建H19-Irp敲除肿瘤小鼠,发现H19-Irp缺乏可减小肿瘤体积,延长小鼠的总生存期,H19-Irp的缺失改变了TME,从而抑制了肿瘤的发生。进一步研究确定H19-IRP通过直接塑造免疫抑制TME影响肿瘤进展,而H19 RNA通过促进肿瘤增殖和侵袭间接改变TME。
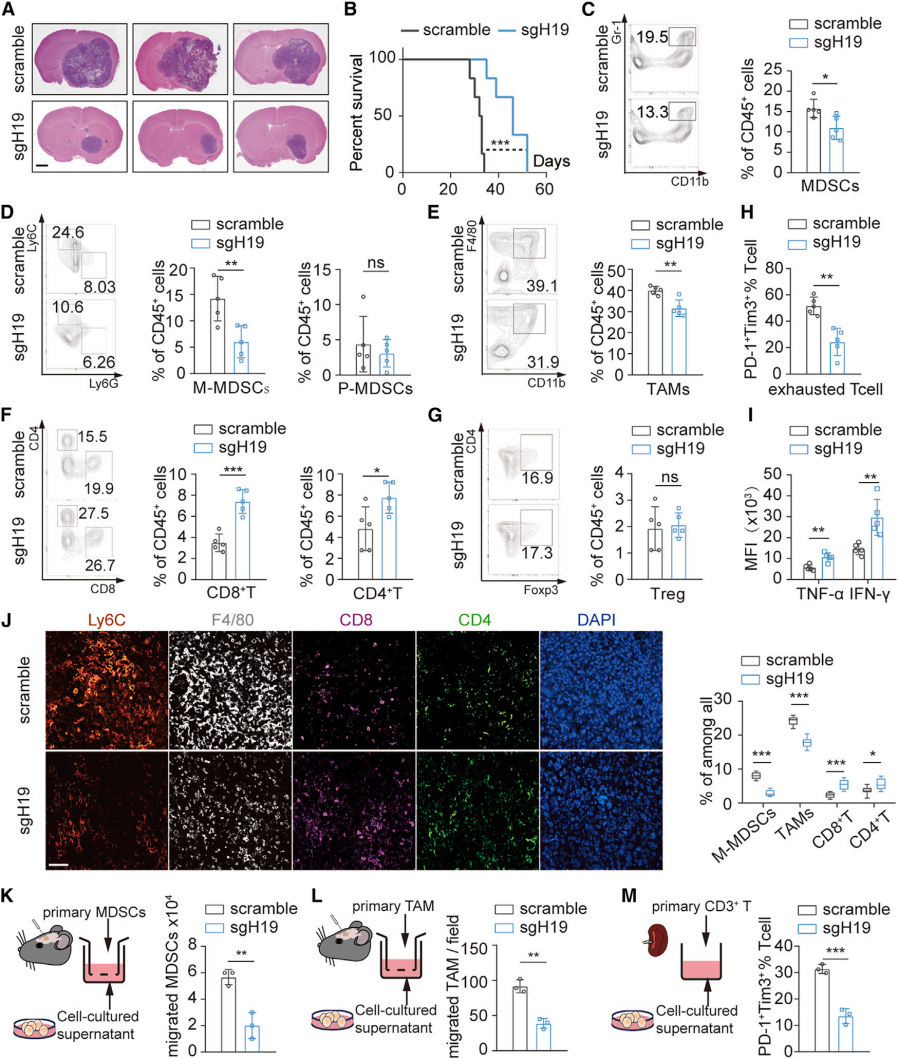
图1. H19-IRP缺乏破坏GBM进展中免疫抑制性TME的形成
2、H19-IRP通过靶向CCL2和Galectin-9形成抑制性TME
为了研究H19-IRP介导免疫抑制的机制,作者通过sgRNAs对H19-IRP敲除或未敲除GL261细胞进行了RNA测序。GO分析显示,与肿瘤免疫相关的单核细胞趋化性下调和细胞对IFN-γ的反应是前20个途径之一。利用qPCR验证发现CCL2和LGALS9(Galectin-9编码基因)在GL261 sgH19细胞中显著下调,进一步实验证明了H19-IRP的缺失显著降低了CCL2和Galectin-9的水平。在体外实验中,GL261细胞中CCL2的缺失显著抑制了MDSCs和TAMs向条件培养基的迁移,而Galectin-9的敲低降低了体外耗尽T细胞的比例,表明H19 IRP通过增加CCL2和Galectin-9来促进TME的免疫抑制。进一步研究发现H19-IRP有助于GBM对ICB治疗的固有抗性,H19-IRP抑制使GBM对ICB治疗敏感。
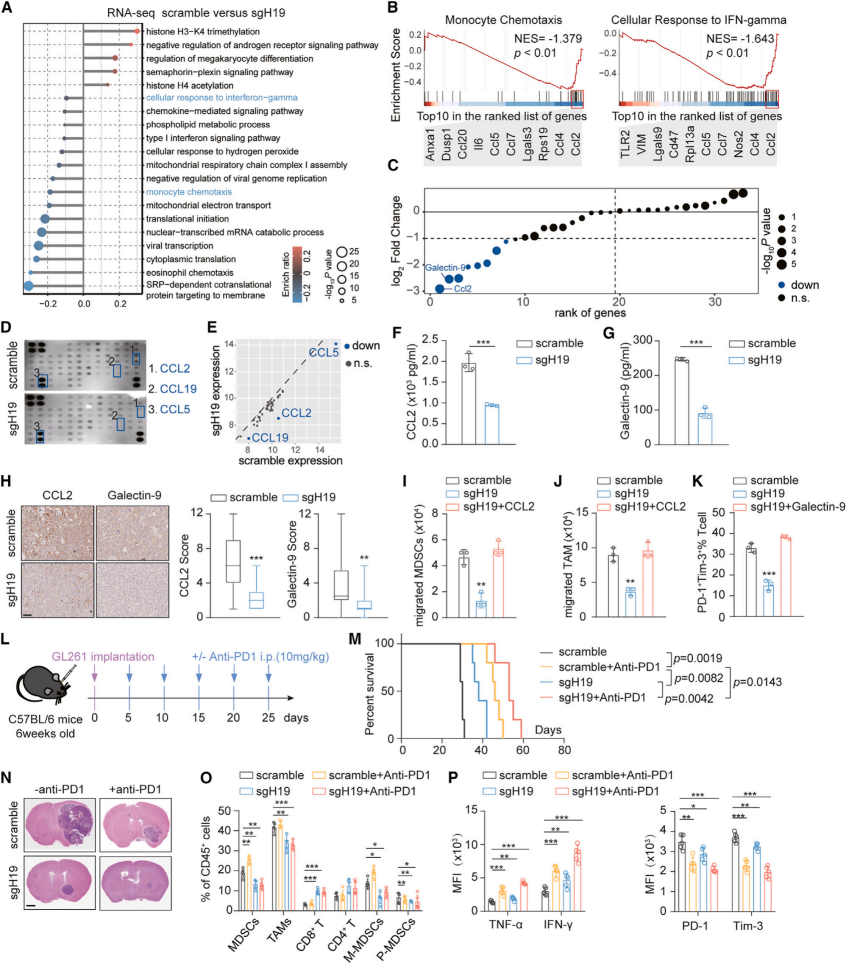
图2. H19-IRP通过靶向CCL2和Galectin-9形成抑制性TME
02 小结
本研究发现Lnc-H19能够编码蛋白产物H19-IRP,并且H19-IRP通过直接激活CCL2和Galectin-9的转录,增强MDSCs/TAM的浸润和T细胞的衰竭,在形成免疫抑制GBM-TME中发挥关键作用。由于H19-IRP在GBM细胞中的高度特异性表达,它也可以作为肿瘤相关抗原,靶向H19-IRP的环状RNA疫苗(circH19-vac)在体内激发有效的T细胞抗肿瘤反应,并在体内抑制GBM的进展。以上发现突出了lncRNA衍生蛋白作为癌症免疫治疗靶点的前景。
